Chemistry Education_Faculty of Mathematics and Natural Sciences_Semarang State University
Chemistry Education_Faculty of Mathematics and Natural Sciences_Semarang State University
Chemistry Education_Faculty of Mathematics and Natural Sciences_Semarang State University
Chemistry Education_Faculty of Mathematics and Natural Sciences_Semarang State University
Chemistry Education_Faculty of Mathematics and Natural Sciences_Semarang State University
Chemistry Education_Faculty of Mathematics and Natural Sciences_Semarang State University
Chemistry Education_Faculty of Mathematics and Natural Sciences_Semarang State University
Minggu, 30 November 2014
Materi Termokimia
06.50
No comments
TERMOKIMIA
C. Entalpi dan Perubahan Entalpi
"Perubahan entalpi suatu reaksi tetap sama, baik berlangsung dalam satu tahap maupun beberapa tahap".
A. Pengertian
Termokimia
Termokimia adalah cabang
ilmu kimia yang mempelajari tentang kalor reaksi, yaitu pengukuran kalor yang
menyertai reaksi kimia. Karena dalam sebagian besar reaksi kimia selalu
disertai dengan perubahan energi yang berwujud perubahan kalor, baik kalor yang
di lepaskan maupun di serap. Kalor merupakan salah satu bentuk energi. James
Prescott joule (1818-1889) merupakan asaz kekekalan energi. “Energi tidak
dapat di ciptakan maupun di musnahkan, tetapi dapat di ubah dari bentuk energi
yang satu menjadi bentuk yang lain.
Jadi, energi yang menyertai suatu
reaksi kimia, ataupun proses fisika hanya merupakan perpindahan atau perubahan
bentuk energi.
Untuk mempelajari perubahan kalor dari
suatu proses perlu dikaji beberapa hal yang berhubungan dengan:
·
Energi yang di miliki oleh suatu zat.
·
Energi tersebut berubah
·
Mengukur perubahan energi tersebut.
·
Bagaimana hubungan energi dengan struktur zat
· karena
entalpi reaksi juga bergantung pada wujud zat harus dinyatakan, yaitu dengan
membubuhkan indeks s untuk zat padat.
Persamaan reaksi yang mengikutsertakan perubahan entalpinya
disebut persamaan termokimia. Nilai ΔH yang dituliskan pada persamaan
termokimia disesuaikan dengan stokiometri reaksi. Artinya jumlah mol zat yang
terlibat dalam reaksi sama dengan koefisien reaksinya.Oleh karena entalpi
reaksi juga bergantung pada wujud zat harus dinyatakan, yaitu dengan
membubuhkan indeks s untuk zat padat.
C. Entalpi dan Perubahan Entalpi
1.
Sistem dan Lingkungan
Sistem
adalah segala sesuatu yang menjadi pusat perhatian yang kita pelajari perubahan
energinya. Sedangkan Lingkungan adalah segala sesuatu yang berada di luar
sistem.
Contoh: Reaksi antara logam seng dengan larutan
asam klorida (HCL) dalam suatu tabung reaksi disertai dengan munculnya
gelembung-gelembung gas.
Pada contoh di atas yang menjadi pusat perhatian adalah logam seng dengan
larutan HCL. Jadi, logam seng dan larutan HCL adalah sistem.
Sedangkan tabung reaksi, suhu udara dan tekanan udara adalah lingkungan.
Berdasarkan interaksinya dengan lingkungan, sistem di bedakan menjadi tiga
macam sebagai berikut:
a. Sistem terbuka, suatu sistem yang memungkinkan
terjadinya pertukaran kalor dan zat (materi) antara lingkungan dengan sistem.
b. Sistem tertutup, suatu sistem yang
memungkinkan terjadinya pertukaran kalor antara sistem dan lingkungannya,
tetapi tidak terjadi pertukaran materi.
c.
Sistem terisolasi (tersekat), suatu sistem tidak yang memungkinkan
terjadinya pertukaran kalor dan materi antara lingkungan dengan sistem.
2. Perubahan
Entalpi
Entalpi (H) suatu zat ditentukan
oleh jumlah energi dan semua bentuk energi yang dimiliki zat yang jumlahnya
tidak dapat diukur. Perubahan kalor atau entalpi yang terjadi selama proses
penerimaan atau pelepasan kalor dinyatakan dengan ” perubahan entalpi
(ΔH) ” . Misalnya pada perubahan es menjadi air, maka dapat
ditulis sebagai berikut:
Δ H = H H20 (l) -H H20 (s) (7)
Kita
amati reaksi pembakaran bensin di dalam mesin motor. Sebagian energi kimia yang
dikandung bensin, ketika bensin terbakar, diubah menjadi energi panas dan
energi mekanik untuk menggerakkan motor. Demikian juga pada mekanisme kerja sel
aki. Pada saat sel aki bekerja, energi kimia diubah menjadi energi listrik,
energi panas yang dipakai untuk membakar bensin dan reaksi pembakaran bensin menghasilkan
gas, menggerakkan piston sehingga menggerakkan roda motor.
Gambar
menunjukkan diagram perubahan energi kimia menjadi berbagai bentuk energi
lainnya.
Harga entalpi zat sebenarnya tidak
dapat ditentukan atau diukur. Tetapi ΔH dapat ditentukan dengan cara
mengukur jumlah kalor yang diserap sistem. Misalnya pada perubahan es menjadi
air, yaitu 89 kalori/gram. Pada perubahan es menjadi air, ΔH adalah
positif, karena entalpi hasil perubahan, entalpi air lebih besar dari pada
entalpi es.
Kita ketahui bahwa termokimia merupakan bagian dari ilmu
kimia yang mempelajari perubahan entalpi yang menyertai suatu reaksi. Pada
perubahan kimia selalu terjadi perubahan entalpi. Besarnya perubahan entalpi
adalah sama besar dengan selisih antara entalpi hasil reaksi dam jumlah entalpi
pereaksi.
3.
Reaksi Eksoterm dan Endoterm
Peristiwa
endoterm (kanan) dan eksoterm (kiri)
a. Reaksi
Eksoterm
Pada reaksi eksoterm terjadi perpindahan kalor dari sistem
ke lingkungan atau pada reaksi tersebut dikeluarkan panas. Pada reaksi eksoterm
harga ΔH = negatif ( – )
Contoh :
C(s) + O2(g) → CO2(g)
+ 393.5 kJ ;
ΔH = -393.5 k
b.
Reaksi Endoterm
Pada reaksi terjadi perpindahan
kalor dari lingkungan ke sistem atau pada reaksi tersebut
dibutuhkan panas. Pada reaksi endoterm harga ΔH = positif ( + )
Contoh :
CaCO3(s) → CaO(s) + CO2(g)-
178.5 kJ ; ΔH = +178.5 kJ
Proses
eksoterm dan proses endoterm
4.
Jenis-Jenis Perubahan Entalpi
- Perubahan entalpi yang diukur pada suhu 25 oC dan tekanan 1 atm ( keadaan standar) disebut perubahan entalpi standar ( dinyatakan dengan tanda DHo atau DH298 ).
- Perubahan entalpi yang tidak merujuk pada kondisi pengukurannya dinyatakan dengan lambang DH saja.
- Entalpi molar = perubahan entalpi tiap mol zat ( kJ / mol ).
- Perubahan entalpi, meliputi :
- a. Perubahan Entalpi Pembentukan Standar ( DHf o ) = kalor pembentukan
Adalah perubahan entalpi yang
terjadi pada pembentukan 1 mol senyawa dari unsur-unsurnya
pada suhu dan tekanan standar ( 25 oC, 1 atm ). Entalpinya bisa dilepaskan
maupun diserap. Satuannya adalah kJ / mol.
Bentuk standar dari suatu unsur adalah bentuk yang paling stabil dari
unsur itu pada keadaan standar ( 298 K, 1 atm ).
Jika perubahan entalpi pembentukan
tidak diukur pada keadaan standar maka dinotasikan dengan DHf
Contoh :
Catatan :
- DHf unsur bebas = nol
- Dalam entalpi pembentukan, jumlah zat yang dihasilkan adalah 1 mol.
- Dibentuk dari unsur-unsurnya dalam bentuk standar.
- b. Perubahan Entalpi Penguraian Standar ( DHd o )
Adalah perubahan entalpi yang
terjadi pada penguraian 1 mol senyawa menjadi unsur-unsur penyusunnya
pada keadaan standar.
Jika pengukuran tidak dilakukan pada
keadaan standar, maka dinotasikan dengan DHd. Satuannya = kJ / mol.
Perubahan entalpi penguraian standar
merupakan kebalikan dari perubahan entalpi pembentukan standar, maka
nilainya pun akan berlawanan tanda.
Menurut Marquis de Laplace, “
jumlah kalor yang dilepaskan pada pembentukan senyawa dari unsur-unsur
penyusunnya = jumlah kalor yang diperlukan pada penguraian senyawa tersebut
menjadi unsur-unsur penyusunnya. “ Pernyataan ini disebut Hukum Laplace.
Contoh :
Diketahui DHf o H2O(l)
= -286 kJ/mol, maka entalpi penguraian H2O(l) menjadi gas
hidrogen dan gas oksigen adalah +286 kJ/mol.
c.
Perubahan Entalpi Pembakaran Standar ( DHc o )
Adalah perubahan entalpi yang
terjadi pada pembakaran 1 mol suatu zat secara sempurna pada keadaan standar.
Jika pengukuran tidak dilakukan pada
keadaan standar, maka dinotasikan dengan DHc. Satuannya = kJ / mol.
Contoh :
d.
Perubahan Entalpi Netralisasi Standar ( DHn o )
Adalah perubahan entalpi yang
terjadi pada penetralan 1 mol asam oleh basa atau 1 mol basa oleh
asam pada keadaan standar.
Jika pengukuran tidak dilakukan pada
keadaan standar, maka dinotasikan dengan DHn. Satuannya = kJ / mol.
Contoh :
DHn reaksi = -200 kJ
DHn NaOH = -200 kJ / 2 mol = -100 kJ/mol
DHn H2SO4 = -200 kJ / 1 mol =
-200 kJ/mol
e.
Perubahan Entalpi Penguapan Standar ( DHovap)
Adalah perubahan entalpi yang
terjadi pada penguapan 1 mol zat dalam fase cair menjadi fase gas pada
keadaan standar.
Jika pengukuran tidak dilakukan pada
keadaan standar, maka dinotasikan dengan DHvap. Satuannya = kJ / mol.
Contoh :
f.
Perubahan Entalpi Peleburan Standar ( DHofus )
Adalah perubahan entalpi yang
terjadi pada pencairan / peleburan 1 mol zat dalam fase padat menjadi
zat dalam fase cair pada keadaan standar.
Jika pengukuran tidak dilakukan pada
keadaan standar, maka dinotasikan dengan DHfus. Satuannya = kJ / mol.
Contoh :
- g. Perubahan Entalpi Sublimasi Standar ( DHosub )
Adalah perubahan entalpi yang
terjadi pada sublimasi 1 mol zat dalam fase padat menjadi zat dalam fase
gas pada keadaan standar.
Jika pengukuran tidak dilakukan pada
keadaan standar, maka dinotasikan dengan DHsub. Satuannya = kJ / mol.
Contoh :
- h. Perubahan Entalpi Pelarutan Standar ( DHosol )
Adalah perubahan entalpi yang
terjadi ketika 1 mol zat melarut dalam suatu pelarut ( umumnya air )
pada keadaan standar.
Jika pengukuran tidak dilakukan pada
keadaan standar, maka dinotasikan dengan DHsol. Satuannya = kJ / mol.
Telah disebutkan bahwa jumlah energi
yang dimiliki sistem dinyatakan sebagai energi dalam (U). Hukum I termodinamika
menyatakan hubungan antara energi sistem dengan lingkungannya jika terjadi
peristiwa. Energi dalam sistem akan berubah jika sistem menyerap atau
membebaskan kalor. Jika sistem menyerap energi kalor, berarti lingkungan
kehilangan kalor, energi dalamnya bertambah.
D. Sistem termodinamika
Sistem termodinamika adalah bagian
dari jagat raya yang diperhitungkan. Sebuah batasan yang nyata atau imajinasi
memisahkan sistem dengan jagat raya, yang disebut lingkungan. Klasifikasi
sistem termodinamika berdasarkan pada sifat batas sistem-lingkungan dan
perpindahan materi, kalor dan entropi antara sistem dan lingkungan.
Ada
tiga jenis sistem berdasarkan jenis pertukaran yang terjadi antara sistem dan
lingkungan:
sistem terisolasi: tak terjadi pertukaran panas, benda atau kerja dengan
lingkungan. Contoh dari sistem terisolasi adalah wadah terisolasi, seperti
tabung gas terisolasi.
sistem tertutup: terjadi pertukaran energi (panas dan kerja) tetapi tidak
terjadi pertukaran benda dengan lingkungan. Rumah hijau adalah contoh dari
sistem tertutup di mana terjadi pertukaran panas tetapi tidak terjadi
pertukaran kerja dengan lingkungan. Apakah suatu sistem terjadi pertukaran
panas, kerja atau keduanya biasanya dipertimbangkan sebagai sifat pembatasnya:
o pembatas adiabatik: tidak memperbolehkan
pertukaran panas.
o pembatas rigid: tidak
memperbolehkan pertukaran kerja.
sistem terbuka: terjadi pertukaran energi (panas dan kerja) dan benda dengan
lingkungannya. Sebuah pembatas memperbolehkan pertukaran benda disebut
permeabel. Samudra merupakan contoh dari sistem terbuka.
Dalam
kenyataan, sebuah sistem tidak dapat terisolasi sepenuhnya dari lingkungan,
karena pasti ada terjadi sedikit pencampuran, meskipun hanya penerimaan sedikit
penarikan gravitasi. Dalam analisis sistem terisolasi, energi yang masuk ke
sistem sama dengan energi yang keluar dari sistem.
Ketika sistem dalam keadaan seimbang dalam kondisi yang
ditentukan, ini disebut dalam keadaan pasti (atau keadaan sistem). Untuk
keadaan termodinamika tertentu, banyak sifat dari sistem dispesifikasikan.
Properti yang tidak tergantung dengan jalur di mana sistem itu membentuk
keadaan tersebut, disebut fungsi keadaan dari sistem. Bagian selanjutnya dalam
seksi ini hanya mempertimbangkan properti, yang merupakan fungsi keadaan.
Jumlah properti minimal yang harus dispesifikasikan untuk
menjelaskan keadaan dari sistem tertentu ditentukan oleh Hukum fase Gibbs.
Biasanya seseorang berhadapan dengan properti sistem yang lebih besar, dari
jumlah minimal tersebut.
Pengembangan
hubungan antara properti dari keadaan yang berlainan dimungkinkan. Persamaan
keadaan adalah contoh dari hubungan tersebut.
E. Hukum-hukum Dasar Termodinamika
Terdapat empat Hukum Dasar yang
berlaku di dalam sistem termodinamika, yaitu:
- Hukum Awal (Zeroth Law) Termodinamika
Hukum
ini menyatakan bahwa dua sistem dalam keadaan setimbang dengan sistem ketiga,
maka ketiganya dalam saling setimbang satu dengan lainnya.
- Hukum Pertama Termodinamika
Hukum
ini terkait dengan kekekalan energi. Hukum ini menyatakan perubahan energi
dalam dari suatu sistem termodinamika tertutup sama dengan total dari jumlah
energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap
sistem.
- Hukum kedua Termodinamika
Hukum
kedua termodinamika terkait dengan entropi. Hukum ini menyatakan bahwa total
entropi dari suatu sistem termodinamika terisolasi cenderung untuk meningkat
seiring dengan meningkatnya waktu, mendekati nilai maksimumnya.
- Hukum ketiga Termodinamika
Hukum
ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini
menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua
proses akan berhenti dan entropi sistem akan mendekati nilai minimum. Hukum ini
juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada
temperatur nol absolut bernilai nol. Ikatan entropi diasosiasikan dengan kekacauan maka pernyataan hukum
kedua termodinamika di dalam proses-proses alami cenderung bertambah ekivalen
dengan menyatakan, kekacauan dari sistem dan lingkungan cenderung semakin
besar.
Di dalam ekspansi bebas,
molekul-molekul gas yang menempati keseluruhan ruang kotak adalah lebih kacau
dibandingkan bila molekul-molekul gas tersebut menempati setengah ruang kotak.
Jika dua benda yang memiliki temperatur berbeda T1 dan T2 berinteraksi,
sehingga mencapai temperatur yang serba sama T, maka dapat dikatakan bahwa
sistem tersebut menjadi lebih kacau, dalam arti, pernyataan "semua molekul
dalam sistem tersebut bersesuaian dengan temperatur T adalah lebih lemah bila dibandingkan
dengan pernyataan semua molekul di dalam benda A bersesuaian dengan temperatur
T1 dan benda B bersesuaian dengan temperatur T2".
Di dalam mekanika statistik,
hubungan antara entropi dan parameter kekacauan adalah, pers. (1):
S
= k log w
Dimana
k adalah konstanta Boltzmann, S adalah entropi sistem, w adalah parameter
kekacauan, yakni kemungkinan beradanya sistem tersebut relatif terhadap semua
keadaan yang mungkin ditempati.
Jika ditinjau perubahan entropi
suatu gas ideal di dalam ekspansi isotermal, dimana banyaknya molekul dan
temperatur tak berubah sedangkan volumenya semakin besar, maka kemungkinan
sebuah molekul dapat ditemukan dalam suatu daerah bervolume V adalah sebanding
dengan V; yakni semakin besar V maka semakin besar pula peluang untuk menemukan
molekul tersebut di dalam V. Kemungkinan untuk menemukan sebuah molekul tunggal
di dalam V adalah, pers. (2):
W1
= c V
dimana
c adalah konstanta. Kemungkinan menemukan N molekul secara serempak di dalam
volume V adalah hasil kali lipat N dari w. Yakni, kemungkinan dari sebuah
keadaan yang terdiri dari N molekul berada di dalam volume V adalah, pers.(3):
w
= w1N = (cV)N.
Jika
persamaan (3) disubstitusikan ke (1), maka perbedaan entropi gas ideal dalam
proses ekspansi isotermal dimana temperatur dan banyaknya molekul tak berubah,
adalah bernilai positip. Ini berarti entropi gas ideal dalam proses ekspansi
isotermal tersebut bertambah besar.
Definisi statistik mengenai entropi, yakni persamaan (1),
menghubungkan gambaran termodinamika dan gambaran mekanika statistik yang
memungkinkan untuk meletakkan hukum kedua termodinamika pada landasan
statistik. Arah dimana proses alami akan terjadi menuju entropi yang lebih
tinggi ditentukan oleh hukum kemungkinan, yakni menuju sebuah keadaan yang lebih
mungkin. Dalam hal ini, keadaan kesetimbangan adalah keadaan dimana entropi
maksimum secara termodinamika dan keadaan yang paling mungkin secara statistik.
Akan tetapi fluktuasi, misal gerak Brown, dapat terjadi di sekitar distribusi
kesetimbangan. Dari sudut pandang ini, tidaklah mutlak bahwa entropi akan
semakin besar di dalam tiap-tiap proses spontan. Entropi kadang-kadang dapat
berkurang. Jika cukup lama ditunggu, keadaan yang paling tidak mungkin sekali
pun dapat terjadi: air di dalam kolam tiba-tiba membeku pada suatu hari musim
panas yang panas atau suatu vakum setempat terjadi secara tiba-tiba dalam suatu
ruangan. Hukum kedua termodinamika memperlihatkan arah peristiwa-peristiwa yang
paling mungkin, bukan hanya peristiwa-peristiwa yang mungkin.
7. Perhitungan Perubahan Entalpi
Reaksi
Perhitungan perubahan entalpi atau
perubahan kalor pada suatu reaksi didasarkan pada Hukum Hess, data entalpi
pembentukan dan data energi ikatan.
7.1 Berdasarkan Hukum Hess
Hukum Hess dikemukakan oleh Germain
Henri Hess. Hukum Hess menyatakan bahwa :
"Kalor reaksi yang dibebaskan
atau diperlukan pada suatu reaksi tidak bergantung pada jalannya reaksi, tetapi
bergantung pada keadaan akhir (zat-zat hasil reaksi)".
Hukum Hess ini dapat juga dinyatakan
sebagai berikut :
"Perubahan entalpi suatu reaksi tetap sama, baik berlangsung dalam satu tahap maupun beberapa tahap".
Contoh, reaksi pembentukan SO3(g)
(1) melalui satu tahap reaksi : S(s)
+ O2(g) → SO3(g) ΔH = - 396 kJ
(2) melalui dua tahap reaksi :
Reaksi (1) : S(s) + O2(g) → SO2(g)
ΔH = - 297
Reaksi (2) : SO2(g) + O2(g) → SO3
(g) ΔH = -99
Jika kedua tahap reaksi pembentukan
SO3(g) dijumlahkan, maka diperoleh kalor reaksi yang sama seperti pada reaksi
pembentukan SO3 (g) pada reaksi (1). Jika kalor reaksi dijumlahkan, maka juga
akan diperoleh kalor reaksi yang sama seperti reaksi pembentukan SO3 (g) pada
reaksi (1).
Reaksi (1) : S(s) + O2(g) → SO2(g)
ΔH = - 297
Reaksi (2) : SO2(g) + O2(g) → SO3
(g) ΔH = -99
S(s) + (g) → SO3(g) ∆H = - 396
Jadi, nilai entalpi reaksi
pembentukan SO3(g) tetap sama, baik berlangsung melalui satu tahap ataupun
beberapa tehap reaksi.
Contoh :
Reaksi (1) : C2H5OH + 3 O2 → 2 CO2 +
3 H2O ∆H = - 1386 kJ
Reaksi (2) : 2 CH3CHO + 5 O2 → 4 CO2
+ 4 H2O ∆H = - 2352 kJ
Tentukan ∆H reaksi : 2 C2H5OH + O2 →
2 CH3CHO + 2 H2O
Jawab :
Perhatikanlah bahwa dari reaksi yang
ditanyakan yang dijadikan patokan adalah 2 C2H5OH dan 2 CH3CHO, sedangkan O2
dan 2 H2O tidak dapat dijadikan patokan karena terdapat pada reaksi (1) dan
reaksi (2). Reaksi (1) dikalikan 2 dan reaksi (2) dibalik sehingga diperoleh :
Reaksi (1) : 2 C2H5OH + 6 O2 → 4 CO2
+ 6 H2O ∆H = - 2772 kJ
Reaksi (2) : 4 CO2 + 4 H2O → 2
CH3CHO + 5 O2 ∆H = + 2352 kJ
2 C2H5OH + O2 → 2 CH3CHO + 2 H2O ∆H
= - 420 kJ
7.2 Berdasarkan Data Entalpi
Pembentukan
Berdasarkan cara ini, data entalpi
yang diketahui harus berupa data entalpi pembentukan. Zat-zat pereaksi dianggap
mengalami reaksi penguraian dan zat-zat hasil reaksi dianggap mengalami reaksi
pembentukan. Jadi, entalpi penguraian suatu zat sama dengan entalpi
pembentukannya, tetapi memiliki tanda berlawanan.
p A + q B → r C + s D ∆Hr = .....?
∆H reaksi = ∆Hf0 hasil reaksi - ∆Hf0
pereaksi
= (r ∆Hf0 C + s ∆Hf0 D) - (p ∆Hf0 A
+ q ∆Hf0 B)
∆Hf0 O2 tidak diikutsertakan dalam
perhitungan entalpi, sebab sesuai dengan kesepakatan, entalpi unsur dalam
bentuk yang lebih stabil dianggap sama dengan nol.
Contoh :
Diketahui kalor pembentukan(∆Hf0)
dari C2H6 (g), CO2(g), H2O(l) masing-masing adalah – 85 , -394 , dan – 286 .
Tentukan ∆Hc0 pembakaran C2H6(g).
Jawab :
Reaksi Pembakaran C2H6(g) :
C2H6(g) + O2(g) → 2 CO2(g) + 3
H2O(l) ∆Hr = ?
∆Hr = ∆Hf0 hasil - ∆Hf0 pereaksi
= ( 2 ∆Hf0 CO2 + 3 ∆Hf0 H2O ) - (∆Hf0
C2H6)
= (- 788) – 858 + 85 = - 1561
Jadi, ∆Hc0 C2H6(g) = - 1561
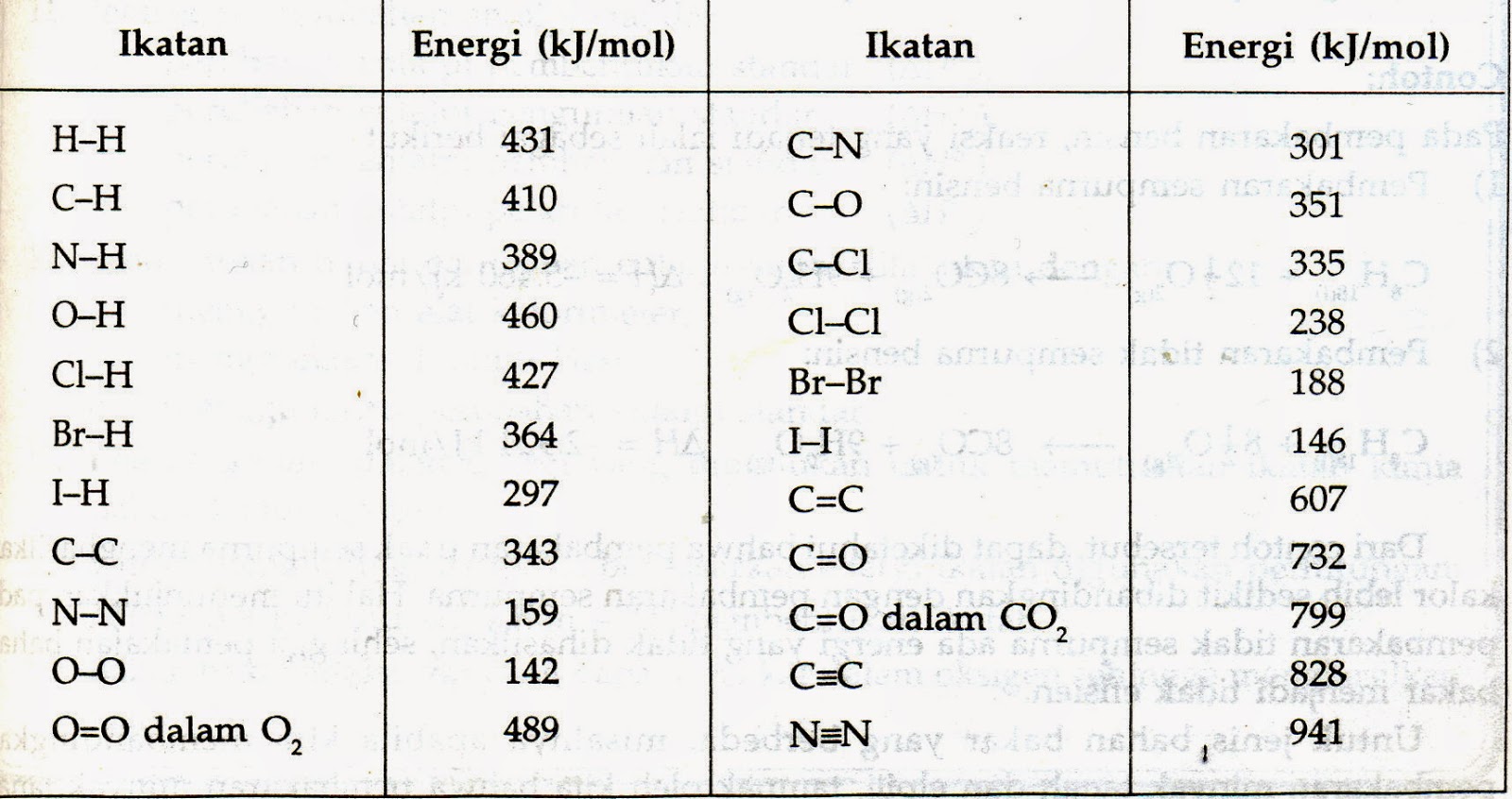
7.3 Berdasarkan Energi Ikatan
Suatu unsur atau senyawa terbentuk
melalui ikatan antaratom penyusunnya. Ikatan-ikatan antaratom ini memiliki
harga energi ikatan tertentu.
Pada saat bereaksi, dianggap semua
molekul pereaksi memutuskan ikatannya sehingga menjadi atom-atom bebas. Proses
pemutusan ikatan memerlukan sejumlah energi, sehingga perubahan entalpinya
bertanda positif. Selanjutnya, atom-atom bebas (hasil penguraian pereaksi) ini
membentukan zat-zat hasil reaksi melalui pembentukan ikatan baru. Peristiwa
pembentukan ikatan membebaskan sejumlah energi, sehingga perubahan entalpi
bertanda negatif.
p A + q B → r C + s D ∆Hr = .....?
∆Hreaksi=(energi total pemutusan
ikatan) - (energi total pembentukan ikatan)
Contoh :
Diketahui kalor pembakaran :
CS2(g) + 3 O2(g) → CO2 (g) + 2
SO2(g) ∆H = - 445 kJ
Energi Ikatan () :
O ═ O = 495
S ═ O = 323
C ═ O = 799
Tentukan nilai energi ikatan C ═ S !
Jawab :
S ═ C ═
S + 3 (O ═
O) → O ═
C ═
O + 2 (O ═
S ═
O) ∆H = - 445 kJ
∆Hreaksi=(energi total pemutusan
ikatan) - (energi total pembentukan ikatan)
445 = (2 × EC═S + 3 × EO═O) - (2 × EC═O + 4 × ES═O)
445 = (2 × EC═S + 3 × 495) - (2 × 799 + 4 × 323)
445 = 2 × EC═S + 1485 - 1598 - 1292
EC═S =
Jadi, energi ikatan C ═ s = 480
Pembakaran bahan bakar dalam mesin
kendaraan atau dalam industri tidak terbakar sempurna. Pembakaran sempurna
senyawa hidrokarbon (bahan bakar fosil) membentuk karbon dioksida dan uap air.
Sedangkan pembakaran tak sempurna membentuk karbon monoksida dan uap air.
Reaksi kimia yang umum digunakan
untuk menghasilkan energi adalah pembakaran, yaitu suatu reaksi cepat antara
bahan bakar denga oksigen yang disertai terjadinya api. Bahan bakar utama
dewasa ini adalah bahan bakar fosil, yaitu gas alam, minyak bumi, dan batu
bara. Bahan bakar fosil itu berasal dari pelapukan sisa organisme.
Reaksi suatu zat dengan oksigen
disebut reaksi pembakaran. Zat yang mudah terbakar adalah unsur karbon,
hidrogen, belerang, dan berbagai senyawa dari unsur tersebut. Pembakaran
dikatakan sempurna apabila karbon (c) terbakar menjadi CO2, hidrogen (H)
terbakar menjadi H2O, belerang (S) terbakar menjadi SO2.
Langganan:
Postingan (Atom)